Analyzing Supercomplexes of the Mitochondrial Electron Transport Chain with Native Electrophoresis, In-gel Assays, and Electroelution
Для візуалізації суперкомплекс мітохондрій використовувалися свежеізолірованние мітохондрії у мишей 17,18. Мітохондріальні суперкомплекс чутливі до повторюваних циклів заморожування і відтавання, що призводить до їх розпаду, хоча це може бути прийнятним для деяких дослідників. Якщо заморожування необхідно для зберігання, щоб забезпечити найкращі результати, зразки не повинні піддаватися більш ніж одному циклу заморожування і відтавання.
Щоб візуалізувати мітохондріальні комплекси ETC з BN PAGE, 100 мкг білка з ізольованих мітохондрій серця завантажували на 4-10% гель (рис. 1А). Плями Кумассі в завантажувальному і катодного буфері достатні для маркування білкових комплексів під час пробігу. Суперкомплекс з'являються після збільшення контрасту в цифровому вигляді (не показано). Для CN PAGE два зразка по 20 мкгF білка з ізольованих мітохондрій завантажували на 3-8% -ний CN-гель і відокремлювали (фіг. 1B). CN PAGE фарбували Кумассі і намагалися візуалізувати білкові комплекси. Після збільшення контрастності в цифровому вигляді з'явилося кілька білкових комплексів з молекулярною вагою, більшим, ніж мономер Cx-I (рис. 1В, праворуч). Концентрації AAB дозволили, щоб найбільші суперкомплекс просто увійшли в гель з лунки. Однак гель, який закінчується градієнтом менше 3% AAB, недостатньо стабільний, щоб маніпулювати для передачі або для вилучення смуги або смуги. Крім того, низька концентрація AAB в верхніх частинах 3-8% CN-гелів підтримує деяку рухливість білкових комплексів, що важливо, якщо враховувати природне електролікування 19.
Мономери і суперкомплекс Cx-I і мономерів, димарів і суперкомплекс CXV є ферментативно активними і можуть бути візуалізовані IGA (рисунок 1C- F). Аналізи показують, що в ізольованих мітохондріях серця Cx-I і Cx-V присутні в білкових комплексах, що перевищують їх відповідні мономери. В аналізі IGA для Cx-I NADH окислюється і електрони переносяться для зниження вмісту нітроцелюлози в тетразолієм. Це призводить до локалізованого синього кольору при молекулярному вазі мономерів Cx-I і Cx-I-містять респірасомах / суперкомплекс (рис. 1C). Активність Cx-V оцінюють по здатності субодиниці F 1 гідролізувати АТФ і можуть бути виконані з використанням гелів CN або BN (рисунок 1D- F). АДФ, що утворюється в результаті цієї реакції, взаємодіє зі свинцем і призводить до утворення білого осаду на рівні мономерів Cx-V, димарів, сінтазомов і подкомплексов (швидше за все, незібрана частина F 1 Cx-V). Зверніть увагу, що олігоміцін усуває lЧто вони містять Cx-V (рисунок 1E).
Для всіх описаних тут експериментів цвіттеріонов миючий засіб, лаурілмалтозід, використовувалося при концентрації 2 мкг / 1 мкг білка, що є найвищою можливою концентрацією, яка зберігає суперкомплекс при одночасному забезпеченні послідовних і відтворюваних результатів (рисунок 1F). Однак ефективність лаурілмалтозіда залежить від кількості партії, умов зберігання та віку. Таким чином, точна концентрація, яка використовується в одній лабораторії, не обов'язково така ж, як і в рукописах. Правильна концентрація детергенту буде солюбілізувати мембрани, але зберегти комплекси і суперкомплекс неушкодженими і повинна визначатися з використанням різних концентрацій лаурілмалтозіда (рис. 1F). Для CN PAGE був підготовлений загальний обсяг зразка 40 мкл на лункуПріведенним тут, в результаті чого співвідношення білка / миючого засобу становить 1 мкг / 2 мкг або ставлення миючого засобу / буфера 1 мкг / 1 мкл (рівне 1,9 мМ). З 40 мкл на кожну лунку міні-гель наносять 30 мкл; Решта використовувалося як аліквоти для виявлення VDAC, контролю завантаження (рисунок 2D).
Для иммуноблоттинга CN є кращим для BN PAGE, оскільки білки не завантажуються Coomassie, що може заважати виявленню антитілами. На малюнку 2 показано виявлення суперкомплекс, що містять білки Cx-I і Cx-V NDUFB6 і ATP5A з ізольованих мітохондрій серця, печінки і мозку. Маркування Ponceau S після перенесення і до иммуноблоттинга може використовуватися для маркування маркерів молекулярної маси і для контролю завантаження білка (малюнок 2A). Це дозволить візуалізувати мономери білкових комплексів ETC на нітроцеллюлітнихOse, але маркування Ponceau S не завжди достатня для візуалізації суперкомплекс мітохондрій (рис. 2A), що може бути досягнуто шляхом иммуноблоттинга.
Cx-I не збирається в димери і тетрамери, як такі, але утворює все більше високомолекулярні суперкомплекс з Cx-III і Cx-IV 14,20,21. Тут, використовуючи антитіло проти NDUFB6, показано, що зразок з серця містить більше мономерів Cx-I і суперкомплекс з високою молекулярною масою (верхні смуги), які мітохондрії з печінки або мозку (рис. 2B). Кількість среднекомплексних респірасомальних суперкомплекс також було значно вище в серці, ніж в інших тканинах (малюнок 2B).
Використовуючи антитіла проти АТФ5А, Мономери Cx-V виявляються в мітохондріях з усіх тканин, в той час як чітка структура смуг, що представляють димери (D) і більші суперкомплекс (SC), які добре видно в мітохондріях серця, не настільки помітна в мітохондріях печінки і мозку (Малюнок 2C). Overexposure (1 хв проти 20 с) імуноблоту показує кілька Cx-V-містять суперкомплекс, які можуть являти собою тетрамери і сінтасоми (рис. 2C). Ці зразки Cx-V-містять білкових комплексів в мітохондріях серця, печінки і мозку показують відмінності, які можуть бути тканеспеціфіческіе і ще не вивчені.
Поступову завантаження цих блотів можна супроводжувати фарбуванням Ponceau S і виявленням VDAC вищевказаної аліквоти за допомогою SDS PAGE, як показано на малюнку 2D.
Не всі антітелаШтампи придатні для виявлення білка в четвертичной або третинної структурі білкового комплексу після нативного PAGE. Щоб подолати цю проблему, цілі і часткові смуги з нативного гелю можуть бути встановлені на денатурує гелі для другого виміру (двовимірні гелі, см. Посилання 13 для демонстрації). 2D-електрофорез є цінним інструментом для візуалізації білків в супрамолекулярної комплексі. Однак, як показано на малюнку 2, суперкомплекс присутні в змінних кількостях, а сигнал окремих білків з суперкомплекс може бути важко візуалізувати в другому, денатурує вимірі. Щоб подолати цю проблему, тут використовувалося електроелементів білкових комплексів з нативних гелів. Це ізолює суперкомплексние смуги з декількох смуг, щоб отримати більше матеріалу для подальшого вивчення.
При використанні електроізлученія тільки цікавить смуга, яка була ідентифікована IGA і / або візуалізувати на BN PAGE, є ісключеніемІСЕД; Білки з цього шматка гелю додатково очищають елюювання з гелю. На фігурі 3А показана смуга BN PAGE, з якої смуги, що представляють мономер, вирізали для електроелюціі. Для оцінки активності Cx-V мономера після електроелюціі елюат наносили на другу CN PAGE. Елюат мономера все ще містить ферментативно активний Cx-V, але також з'являються підкомплекси (рисунок 3B). Срібне фарбування елюата після нативного CN PAGE (рисунок 3C) або денатурація SDS PAGE (малюнок 3D) вказує на присутність білків в елюаті, а імуноблотинг проти ATP5A вказує на присутність Cx-V в обох зразках (малюнок 3D).
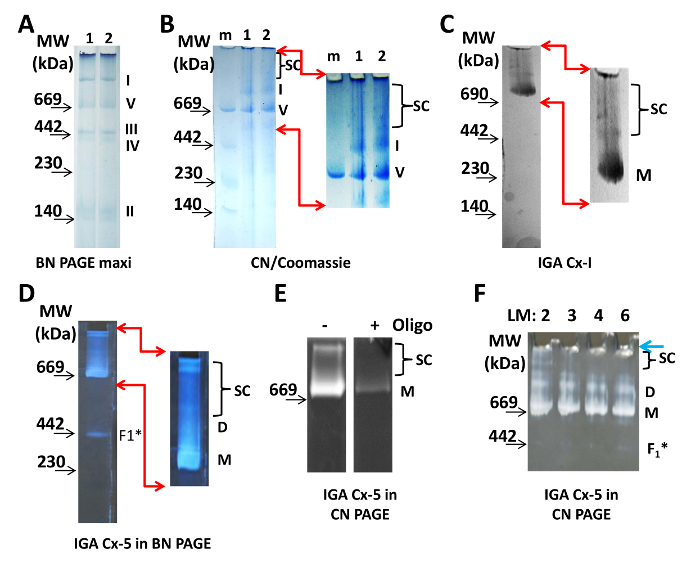
Малюнок 1: Візуалізація Мітоха Ondrial суперкомплекс. (A) Дві смуги 4-10% BN maxi-gel із зразками ізольованих мітохондрій серця. Аліквоти одного і того ж зразка проводили на обох доріжках при 100 мкг білка на лунку. Мономери білкових комплексів I, II, III, IV і V ETC добре видно і позначені праворуч від гелю. (B) Два зразка мітохондрій серця (1 і 2, 20 мкг білка / смуги) поділяли на CN PAGE і візуалізували фарбуванням Кумассі. SC вказує положення суперкомплекс після збільшення і цифрового поліпшення верхньої частини гелю (область позначена червоними стрілками). (C) 20 мкг мітохондріального білка розділяли на 3-8% CN PAGE і обробляли для Cx-I IGA. Зображення зі збільшеним і цифровим зображенням демонструють смуги продукту реакції Cx-I. (D) 20 мкг мітохондріального білка відокремлювали на 3-8% BN PAGE і обробляли для Ix Cx-V. Вражає Ed і цифрове зображення демонструють смуги продукту реакції Cx-V. (E) 50 мкг мітохондріального білка розділяли на 5-15% CN PAGE і обробляли для Ix Cx-V без (-) і з (+) 5 мкг / мл олігоміціна (оліго). (F) Мітохондріальний білок (20 мкг / л) солюбілізірованних з 2-6 мкг лаурілмалтозіда / 1 мкг білка, як зазначено у верхній частині гелю, і розділяли на 3-8% CN-гелі, а потім Cx- V IGA. Всі знімки були сфотографовані або за допомогою світлого столу (A - C), або з чорної поверхні (D - F). Специфікації камери наведені в Таблиці матеріалів. Розташування маркерів молекулярної маси (MW) зазначено на лівій стороні всіх панелей. Скорочення: D = димери; F 1 * = подкомплекс Cx-V; LM = лаурілмалтозід; M = маркер молекулярної маси; M = мономери; SC = суперкомплекси.G1large.jpg "target =" _ blank "> Натисніть тут, щоб переглянути збільшену версію цього малюнка.
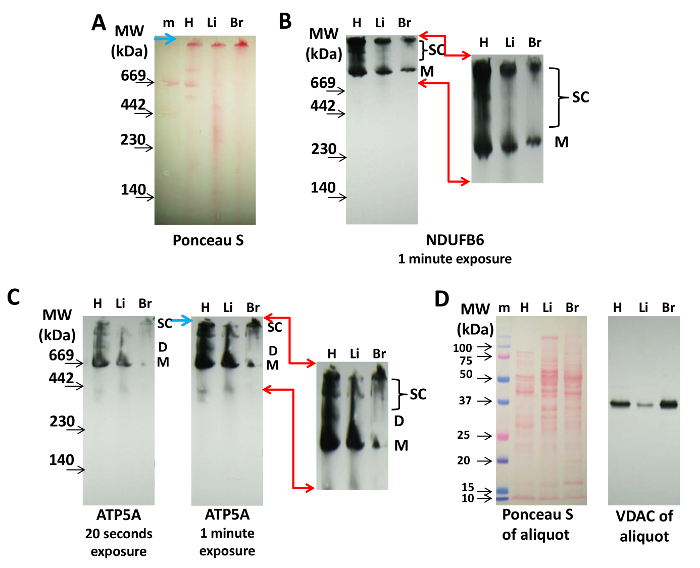
Малюнок 2: Виявлення суперкомплекс мітохондрій методом иммуноблоттинга. 20 мкг білка з серця (H), печінки (Li) і мітохондрії головного мозку (B) поділяли на 3-8% CN PAGE і переносили на нітроцелюлозну мембрану. (A) фарбування Ponceau S мембрани вказує на наявність білкових комплексів і маркерів молекулярної маси (м). Синя стрілка вказує на верхню частину гелю. (B) Білок Cx-I, NDUFB6, був іммуноблотрован на блоттинга, показаному в (A) (час експозиції 1 хв). (C) Cx-V візуалізували анти-ATP5A-антитіло (20 с і 1-хвилинним впливом, як зазначено). Червоні стрілки в (B) і (C) вказують область, збільшену і збільшену цифру для visuaЛізірованіе Cx-I- і Cx-V-містять суперкомплекс, а синя стрілка вказує на верхню частину гелю. (D) Ponceau S і іммунокалібровку аліквоти VDAC кожного екстракту, використовуваного в (A), (B) і (C), які розділяли SDS PAGE і переносили в нитроцеллюлозу. Скорочення: M = мономери Cx-I або Cx-V, D = димери Cx-V, SC = суперкомплекс, що містять Cx-I або Cx-V. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
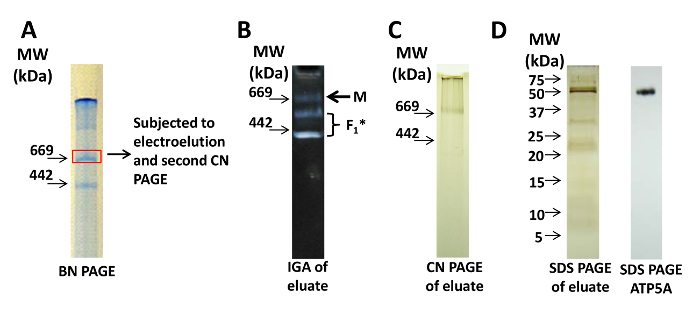
Малюнок 3: Електроізлученіе Cx-V. (A) BN PAGE зразка мітохондрій. Коробчата смуга являє собою мономер Cx-V, який був вирізаний і електроелементів. (B) Елюат піддавали CN PAGE, а подальша IGA для Cx-V демонструє мономери (M) І підкомплекси, що містять F 1 з Cx-V. (C) Срібне фарбування CN PAGE елюата демонструє мономери (M). (D) Срібне фарбування (ліва панель) і імуноблот для ATP5A (права панель) денатурирующего натрієвого додецилсульфата (SDS) PAGE елюата вказує на присутність Cx-V. Для SDS PAGE см. Протоколи, опубліковані в інших місцях. Натисніть тут, щоб переглянути збільшену версію цього малюнка.
